返回

「信诺维」在研新药依格美妥司他(XNW5004)最新研究进展
2025年5月31日,芯云伙伴企业「信诺维」,一家以创新科技守护人类健康为使命、集科研与商业化于一体的平台型创新药公司,宣布其自主研发的在研1类新药EZH2抑制剂——依格美妥司他(XNW5004)的重磅研究成果在2025年美国临床肿瘤学会(ASCO)年会上首次公布,彰显信诺维在血液瘤领域全球差异化竞争中的新优势。
更多详情
摘要编号:7012
展示形式:口头报告
展示时间:2025年5月31日 8:00-9:30 (GMT-5)

依格美妥司他重磅研究成果在2025年ASCO年会上首次公布
2025年ASCO年会在美国芝加哥举行。ASCO 年会是全球肿瘤领域最权威的学术交流盛会,每年都会展示当前国际最前沿的临床肿瘤学科研成果和治疗技术。
对于R/R FL患者,依格美妥司他的疗效潜力显著优于已附条件上市的同类产品
在信诺维公布的依格美妥司他治疗复发/难治性非霍奇金淋巴瘤的 I/II 期临床研究中,截至2024年12月18日,共入组 120 例既往接受至少两线全身系统治疗的复发/难治性非霍奇金淋巴瘤患者,整体安全性和耐受性良好,无DLT事件发生,最终选择 1200mg 作为临床II期推荐剂量(RP2D)。在 1200mg 剂量下:
- 复发或难治性滤泡性淋巴瘤(以下简称 “R/R FL”)队列(N=30)的ORR为66.7%(见图 1),DCR为100%,mPFS为10.8m;
- EZH2 突变型 R/R FL 的ORR 为70%;
- EZH2 野生型 R/R FL 的ORR 为63.2%。

图1. FL队列靶病灶SPD相对基线最佳变化百分比的瀑布图
对于R/R FL患者,依格美妥司他展现出的疗效潜力显著优于已附条件上市的同类产品。国家药品监督管理局药品审评中心(CDE)于2025年5月授予依格美妥司他突破性治疗药物品种认定,用于既往接受过至少3线全身系统治疗的R/R FL(EZH2野生型)。
依格美妥司他在R/R PTCL治疗中展现出显著优于同类已上市产品及在研同类药物的潜在优势
- R/R PTCL队列(N=37)的ORR为70.3%(见图2),mPFS为15.7m;
- 外周T细胞淋巴瘤非特指型(PTCL-NOS)的ORR为72%;
- 血管免疫母细胞性T细胞淋巴瘤(AITL)的ORR为68.2%。
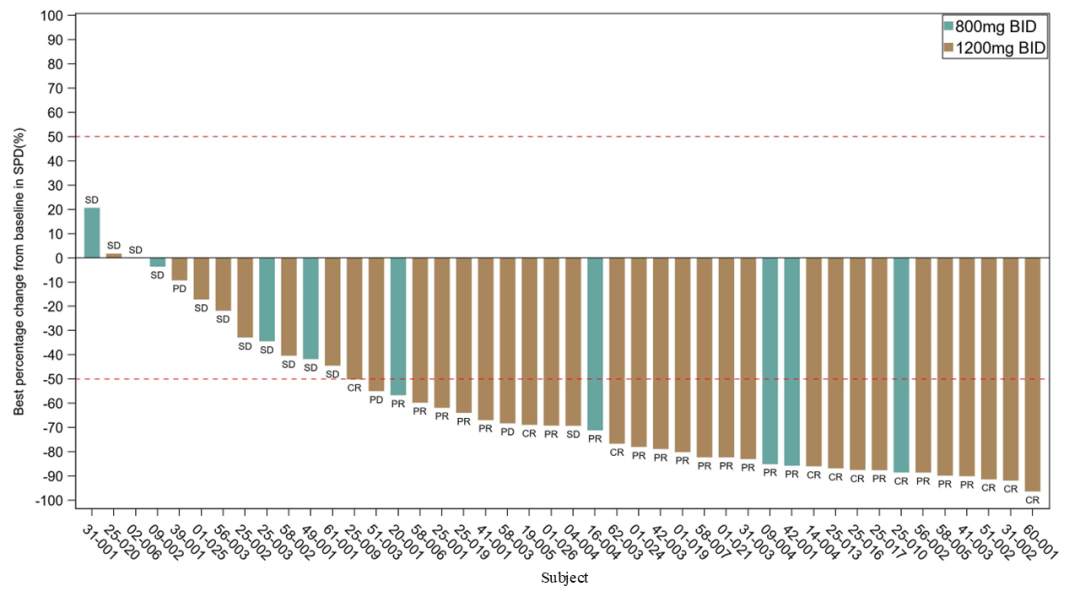
图2. PTCL队列靶病灶SPD相对基线最佳变化百分比的瀑布图
无论在肿瘤缓解率还是PFS方面,依格美妥司他在 R/R PTCL中都展现出显著优于同类已上市产品及在研同类药物的潜在优势。国家药品监督管理局药品审评中心(CDE)于2024年9月授予依格美妥司他突破性治疗药物品种认定,拟用于治疗 R/R PTCL。目前依格美妥司他拟治疗外周T细胞淋巴瘤的关键注册临床试验正在进行中。


 粤公网安备44030502006866号
粤公网安备44030502006866号